药品试验数据保护制度浅谈
药品上市许可制度是政府对药品进入市场进行行政管理,并对其质量、安全和药效进行监管的体现。对于药品研发企业而言,药品研发需要投入巨大的时间和金钱精力,新药上市前需要反复和繁杂的临床试验。药品研发企业在申请药品注册上市时,需要提供真实、充分、可靠的数据、资料和样品,证明药品的安全性、有效性和质量可控性。[1] 由于新药研发的成功率十分有限,因此在申请药品注册上市时提供的药品实验数据具有极高的经济价值。很多发达国家和地区为保护药品研发企业在上市许可过程中所提交的试验数据,给予药品研发企业一段时间的数据保护。所以,药品知识产权制度的主要目的之一是在保护药品企业市场、激励药品研发与保证药品可及性及医疗卫生的公共服务性质之间保持平衡。
中美贸易协定在知识产权章节强调了药品知识产权的重要性,中国应提供和执行有效保护药品相关知识产权,其中包括药品专利链接制度和药品试验数据保护制度等。可见,药品知识产权制度不仅关系到中美贸易的稳定发展,亦对中国建设创新型国家,促进高质量经济发展有着重要作用。
一、什么是药品试验数据?
根据《与贸易有关的知识产权协定》(TRIPS)第39条第三项中规定:“各成员如要求,作为批准销售使用新型化学个体制造的药品或农业化学物质产品的条件,需提交通过实质性努力取得的、未公开的试验数据或其他数据,则应保护该数据,以防止不正当的商业使用”; [2]我国《药品试验数据保护实施办法(暂行)(征求意见稿)》第4条规定:“本办法中试验数据是指,药品上市申请人根据要求所提交的药品上市注册申请文件数据包中与药品有效性相关的非临床和临床试验数据,但是与药品安全性相关的数据除外,并应满足以下条件:(一)以获得药品上市许可为目的提交药品注册申请资料中所要求提交的数据;(二)提交药品注册申请前未公开披露;(三)未依赖他人的试验数据或已公开发布的研究成果自行取得”。
药品试验数据是独立于专利保护客体之外的,是药品研发公司为获得上市许可而提交的重要且未公开的药品研究数据。药品试验数据在上市前可作为药品研发企业商业秘密保护,但是药品上市则需披露上述试验数据给国家药品监管部门,从而丧失以商业秘密作为其保护方式。药品试验数据制度则为保护和奖励为获得上述数据付出的巨大努力的药品研发公司,给予其在一段时间内独占试验数据,并阻止他人使用该试验数据上市申请的保护制度。虽然,药品试验数据保护与专利权保护无必然关系,但是其属于重要的知识产权制度之一。
二、我国药品试验数据制度概览
我国的药品试验数据保护起源于2001年《中国加入WTO议定书》中,基于对TRIPs第39条第三项[3]作出“对于未披露的试验数据提供保护,保护期限至少为6年”的承诺;并且在2002年实施的《药品管理法实施条例》以及于2007年修订的《药品注册管理办法》中体现了药品数据保护制度;但是,2020年修订的《药品注册管理办法》并未体现试验数据保护制度。
2018年4月26日,国家食品药品监督管理总局(“药监局”)公布的《药品试验数据保护实施办法(暂行)(征求意见稿)》(“《征求意见稿》”),与之前2007年修订的《药品注册管理办法》相比,进一步细化了保护药品试验数据、鼓励新药研发及创新的保护机制。
为方便读者了解我国现有药品管理关于试验数据相关规定,表1对我国现行药品监管法律法规及相关政策进行简单梳理:



我国现有的法律法规中,只有《药品管理法实施条例》(2019修订)中直接体现了试验数据保护制度,对新型化学成份药品给予6年的保护期。2018年4月26日,国家药品监督管理局办公室发布的《征求意见稿》中,扩大试验数据保护范围包括创新药、创新的治疗用生物制品、罕见病治疗药品、儿童专用药,以及专利挑战成功的药品[5];并针对不同的药品类型给予不同的数据保护期[6],具体如下:
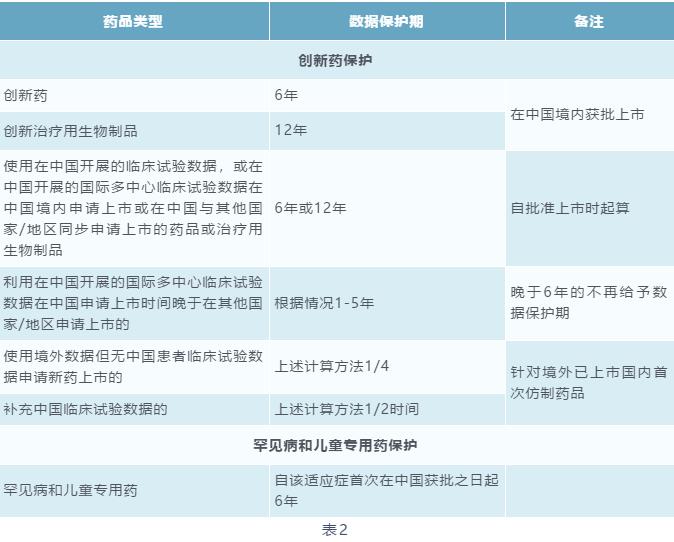
《征求意见稿》中对治疗用生物制品实施12年的强数据保护,还规定了药品试验数据保护实施方式、处理模式、异议解决机制、效力认定等,但是未提及监管机制和法律后果。另外,药品试验数据保护期的起算节点为药监局获批之日,针对同一药品先后授予的各项保护期,分别按照相应药品注册申请自被批准之日起分别计算。但是,针对未获批的药品的试验数据能否获得保护,以及获得何种保护仍然存疑。该《征求意见稿》也将受中美贸易磋商的影响,目前该立法工作尚无明显进展。
三、其他国家和地区关于药品试验数据的规定
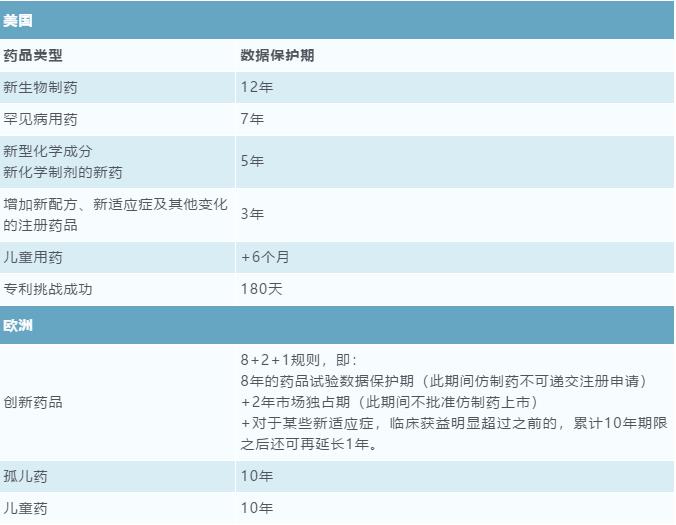
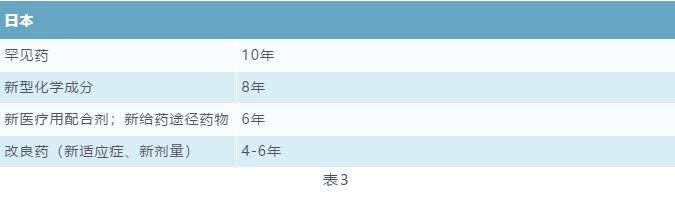
药品试验数据保护制度首次出现在美国《药品价格竞争与专利期恢复法》(Drug Price Competition and Patent Term Restoration Act),欧洲、日本等国家和地区亦纷纷引入该制度。[7]但是各国对于“试验数据保护”的理解和具体规定并不相同。如美国所引用的是“Data Exclusively”( 独占数据),欧洲引用“Data Protection”(数据保护),日本则提供市场监控期(Post Marketing Surveillance)也叫重新审核期(Reexamination Period)。不同国家针对不同药品类型的试验数据保护期具体规定也不相同[8],具体如下:
四、展望
药品试验数据保护制度对新药研发具有激励作用,适当的保护有利于推进社会公众生命健康发展。但是,不同国家和地区的医药发展水平不同,故对药品试验数据保护的力度也不尽相同。随着,我国医药行业的发展,药品注册数量大大增加;同时作为发展中国家对药品可及性的要求等,也对我国的医药监管制度和药品知识产权制度提出了更高的要求,我国有关药品的知识产权制度也在逐步完善。
我国现有法律体系中,《药品管理法实施条例》对药品试验数据保护制度进行了明确规定;国务院等行政部门多次明确将进一步完善和落实药品试验数据保护制度。2018年的《征求意见稿》进一步规定了药品试验数据保护制度,将现有法律中仅针对新型化学成份药品的试验数据保护扩大到创新药、创新的治疗用生物制品、罕见病治疗药品、儿童专用药,以及专利挑战成功的药品。但是,该《征求意见稿》中对生物制药试验数据强保护的合理与否,以及缺少对创新药/新型化学成份药品的明确定义、试验数据保护的具体实施程序规定、监管要求和法律后果等,均需立足我国实际和借鉴国际经验的基础上进一步完善。
此外,实践中不少人也提到我国试验数据保护制度除了借鉴发达国家和地区的相关制度外,还需要包括中药试验数据保护制度。但是,TRIPs协议仅涉及化学物质产品,不明确涉及中药试验数据保护要求,因此会在一定程度上影响我国对于中药试验数据保护的动力。从另一方面,尽管我国中药一般也需毒理和临床试验数据方可在中国上市[9],但是为推进中药发展,中药新药注册优化简化流程正在逐步推进。根据我国《中医药法》,中药上市与化学药、治疗用生物制品上市流程并不完全一致,如生产符合国家规定条件的来源于古代经典名方的中药复方制剂,在申请药品批准文号时,可以仅提供非临床安全性研究资料[10]。另外,中药的知识产权保护除利用专利权、商业秘密、地理标志产品保护外,《中药品种保护条例》针对中药一级保护品种和中药二级保护品种亦给予了特殊保护期限。从这些角度看,如何保护中药的试验数据、对于不同中药药品如何给予平等保护、中药试验数据保护制度如何与化学药品实验数据衔接,在鼓励中药应用的公共利益和中药数据排他保护的企业利益间如何平衡等,还需要进一步讨论,因此短期内对于中药药品试验数据的保护制度可能还不会落实。
【注】
[1] 如《药品注册管理办法》(2020年)第十条第二款规定
[2] 与贸易有关的知识产权协定(TRIPS)
http://ipr.mofcom.gov.cn/zhuanti/law/conventions/wto/trips.html
[3] 同上
[4] 原《药品注册管理办法》第20条规定,按照《药品管理法实施条例》第三十五条的规定,对获得生产或者销售含有新型化学成份药品许可的生产者或者销售者提交的自行取得且未披露的试验数据和其他数据,国家食品药品监督管理局自批准该许可之日起6年内,对未经已获得许可的申请人同意,使用其未披露数据的申请不予批准;但是申请人提交自行取得数据的除外。
[5] 国家药品监督管理局办公室公开征求《药品试验数据保护实施办法(暂行)》意见第3条
[6] 国家药品监督管理局办公室公开征求《药品试验数据保护实施办法(暂行)》意见第5条、第6条
[7] 杨建红,王晓东,陈亭,韩鹏. 各国生物制品数据保护制度对比研究及完善我国生物制品数据保护制度的建议 [J]. 现代药物与临床, 2018, 34(4):921-925;褚童.TRIPS协定下药品试验数据保护研究[M].北京:知识产权出版社.2015, p42-43.
[8] 同上
[9] 《药物临床试验质量管理规范》第77条(17)款:中药民族药研究者手册的内容参考以上要求制定。还应当注明组方理论依据、筛选信息、配伍、功能、主治、已有的人用药经验、药材基原和产地等;来源于古代经典名方的中药复方制剂,注明其出处;相关药材及处方等资料。
[10] 《中医药法》第30条规定。





