《生物医学新技术临床研究和临床转化应用管理条例》正式发布:新规落地与产业新局
一、《条例》与《征求意见稿》:监管框架的演变与升级
《条例》共计五十八条,总体以“总则-临床研究备案-临床研究实施-临床转化应用-监督管理-法律责任-附则”的逻辑行文,覆盖生物医学新技术从临床研究到转化应用的全过程。在规范临床研究方面,《条例》明确临床研究的前提和红线、临床研究机构的条件,细化备案程序,加强临床研究实施管理;在临床转化应用方面,《条例》规定了临床转化应用的条件和程序,保障临床转化应用质量安全,同时根据科学研究的发展,可对临床转化应用的生物医学新技术进行再评估,为未来科技发展、认识深化等可能出现的情况留下监管空间。
相较于2019年发布的《征求意见稿》,《条例》在生物医学新技术定义、监管主体与模式、转化应用审批、法律责任与罚则等方面有所变动。同时,《条例》还新增优先审查、紧急应用、在线服务系统、受试者随访监测等创新条款。
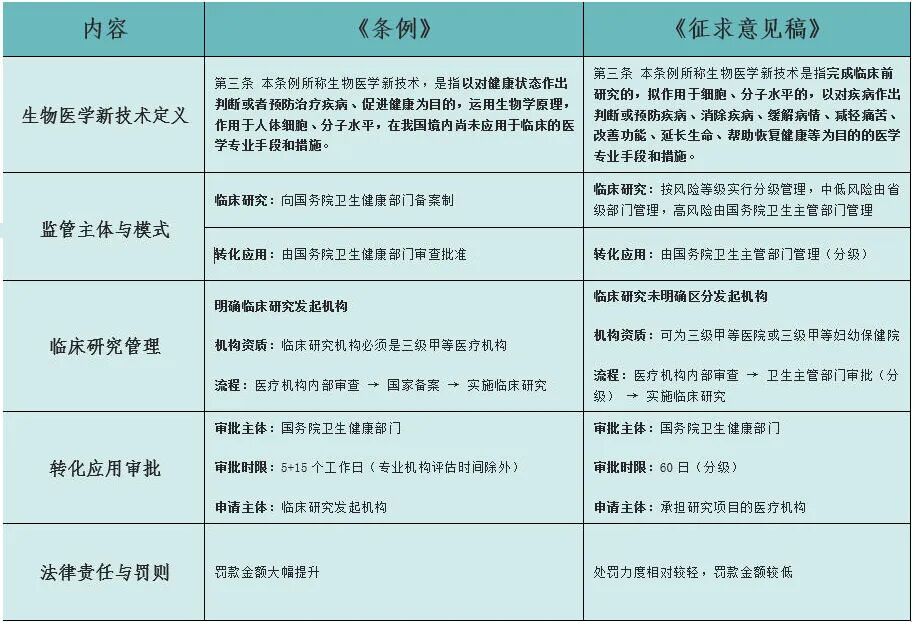
首先,《条例》第三条首次在国家立法层面明确了“生物医学新技术”的定义,并在其适用目的中增加了“对健康状态作出判断”的表述,相较于《征求意见稿》中仅聚焦于疾病治疗的范围,体现出监管范畴的扩展与立法意图的与时俱进。其次,在监管机制方面,《条例》将临床研究的备案与转化应用的审批权限统一限于国家层面,不再沿用以往按风险等级实行分级管理的模式,强化了集中监管的一致性。在临床研究管理层面,《条例》明确提出了“临床研究发起机构”这一主体,并明确其在后续转化应用阶段作为申请主体向国务院卫生健康部门申请审批,进一步理顺了权责关系。在法律责任方面,《条例》大幅提高了罚款额度,并细化了对违规机构及个人的惩戒措施,包括一定期限或终身的从业禁止、吊销执业资格等。
与2019年《征求意见稿》相比,《条例》构建起“临床研究备案-临床研究-转化应用-监管-罚则”的完整闭环的逻辑结构,逻辑严密、权责清晰,体现出在鼓励技术创新与保障技术安全、伦理合规之间的审慎平衡。国家层面的集中监管与严厉罚则相结合,有助于严守安全底线,引导行业规范发展。此外,《条例》确认了“临床研究发起机构”的法律地位,也证明生物医学新技术企业、科研机构等主体作为临床研究发起机构在生物医学新技术创新和转化应用过程中的核心驱动作用。
然而,现阶段《条例》在具体实施层面仍有若干问题亟待进一步明确,例如生物医学新技术的具体范畴、转化应用阶段学术审查与伦理审查的具体机制与实施主体,以及该阶段医疗机构应具备的资质条件等关键内容,均需配套细则予以落实。
二、《条例》与地方性法规:区域探索与创新空间
2024年至2025年,地方在生物医学新技术领域也同步进行创新与探索,《海南自由贸易港博鳌乐城国际医疗旅游先行区生物医学新技术促进规定》《湖南省细胞和基因产业促进条例》等地方性法规相继出台。海南省依托自贸港政策优势“先行先试”,在技术转化应用、真实世界数据应用、进口研发物品“正面清单”管理、通关便利化以及国际多中心临床合作等方面展开探索;湖南省则聚焦细胞与基因产业,系统覆盖从细胞采集、存储、研发到生产、应用的全产业链环节,推动形成闭环发展的产业生态。现阶段,《条例》作为国家层面立法,则确立了以安全与伦理为底线、以国家备案审批为核心的全过程监管框架,为产业规范发展奠定了更加坚实的制度基础。
未来,我国生物医学新技术领域将呈现中央统筹监管与地方特色探索并行的双轨发展路径。各地在推进相关立法与政策实践的过程中,应始终严守安全与伦理红线,在区域协同与差异化布局的同时,着力突破资源配套与资质准入等瓶颈。
三、新监管时代下的产业发展新局
《条例》的颁布实施,标志着我国生物医学新技术产业将逐渐从探索期向“强监管、明责任”的新发展阶段过渡,风险防控也从“被动”走向“主动”。对“临床研究发起机构”,即科研机构、企业等主体而言,其角色定位从“技术提供方”“参与者”“辅助者”向“责任主体”转变,建立覆盖临床前研究、临床研究、转化应用的全流程合规体系十分重要。对医疗机构来说,其作为临床研究的实施主体,则须强化伦理审查与内部治理能力,严格履行知情同意与风险管控义务,承担起保障临床研究质量与受试者安全的首要责任。同时,根据《条例》第五十七条规定,在《条例》施行前已经开展的生物医学新技术临床研究的,临床研究机构可以按照临床研究方案继续实施,但应当在2026年6月1日前依照《条例》的规定进行备案。
从产业全局看,《条例》从临床前研究、临床研究备案、临床研究实施到转化应用,形成完整监管链条,有利于控制技术风险、伦理风险和安全风险,产业发展将在更加安全、规范的轨道上进行。同时,《条例》也强调准入门槛,推动产学研医协同,明确医疗机构开展临床应用可以按照规定收取费用,规范了技术商业化路径。
四、结语
《条例》的出台,标志着我国生物医学新技术监管体系迈向法治化、全链条化的重要一步。通过明确技术定义、统一国家层面监管、强化主体责任与罚则,《条例》在鼓励创新的同时筑牢了安全与伦理底线。与早期《征求意见稿》及地方性探索相比,《条例》在权责划分、程序及条件资质要求上更为清晰严密,为科研机构、企业及医疗机构指明了合规路径与发展方向。未来,在中央统筹与地方特色并行的路径下,生物医学新技术产业将在规范中迈向高质量发展新阶段。







